ATOME
Un atome est le constituant élémentaire de la matière.
Un atome est constitué d’un noyau positif entouré d’électrons négatifs.
Le noyau est constitué de protons positifs et de neutrons neutres. La charge positive du noyau vient donc des protons.
Le nombre de protons du noyau est noté Z, c’est le numéro atomique.
Le nombre total de nucléons, neutrons + protons, est noté A, c’est le nombre de nucléons.
Le symbole du noyau de l’atome dont le symbole est X est AZX.
Par exemple, le carbone 14 a un noyau qui s’écrit : 146C, il possède 6 protons et 14 nucléons en tout.
Donc pour connaître le nombre de neutrons, on effectue la soustraction A-Z.
Par exemple, le carbone 14 possède 14-6=8 neutrons.
Comme l’atome est neutre, il possède autant d’électrons que de protons.
Toujours avec le carbone, il possède 6 protons donc 6 électrons.

Exemples :
- Que contient un atome d’oxygène dont le noyau s’écrit : 188O ?
Il contient 8 protons, 18-8=10 neutrons et, comme l’atome d’oxygène est neutre, 8 électrons.
- Que contient le noyau de chlore 35, 3517Cl ?
Il contient 17 protons, 35-17=18 neutrons et 0 électrons, car on ne trouve pas d’électron dans un noyau.
Les électrons ne sont pas disposés n’importe comment autour du noyau. Ils sont répartis sur des couches, appelées K, L, M, etc.
La première couche, K, la plus proche du noyau, est aussi la plus petite. Elle ne peut contenir au maximum que 2 électrons. Un troisième électron doit se placer sur la couche L.
Ensuite, on commence une nouvelle couche lorsqu’on arrive à 8. Par exemple, on ne peut pas placer 9 électrons sur L : il en faut 8 sur L et 1 sur M.
On remplit toujours les couches les plus internes d’abord.
Illustration :

Exemples :
Le carbone 6C : 6 protons donc 6 électrons. (K)2(L)4.
Le magnésium 12Mg : 12 électrons. (K)2(L)8(M)2.
ION
Une espèce chimique possédant une charge électrique est un ion. Par exemple, l’ion hydrogénocarbonate HCO3- possède une charge négative. L’ion ammonium NH4+ possède une charge positive.
Lorsque cette espèce est tirée d’un atome unique, on l’appelle ion monoatomique. Exemple, l’ion sodium Na+ possède une charge positive, l’ion oxygène O2- deux charges négatives.
Lorsqu’un atome gagne un électron : il possède alors une charge négative en plus. Comme il était neutre, il devient chargé négativement, avec une charge « - ». Par exemple l’ion chlorure Cl- possède 18 électrons. Car le noyau de chlore s’écrit 17Cl, l’atome possède 17 électrons. S’il gagne 1 électron, il possède 18 électrons négatifs et 17 protons positifs, donc globalement, une charge négative.
Donc : un ion monoatomique est un atome ayant gagné ou perdu un ou plusieurs électrons.
Exemples :
L’ion sodium Na+. Z(Na)=11. Le noyau de sodium possède 11 protons, donc l’atome de sodium possède 11 électrons. L’ion Na+ possède une charge « + », donc il a perdu 1 électron. Il en reste 10 : (K)2(L)8.
L’ion oxygène O2-. Z(O)=8. L’atome d’oxygène possède 8 électrons. L’ion O2- en a gagné 2, il en possède donc 10, (K)2(L)8.
Exercice :
Trouver la répartition électronique des ions : 17Cl-, 16S2-, 12Mg2+, 19K+.
Ion chlorure Cl- : (K)2(L)8(M)8
Ion soufre S2- : (K)2(L)8(M)8
Ion magnésium Mg2+ : (K)2(L)8
Ion postassium K+ : (K)2(L)8(M)8
RÈGLES DU DUET ET DE L’OCTET
Tous les atomes réagissent de manière à obtenir 8 électrons sur la couche la plus externe (octet) ou 2 électrons pour les atomes les plus petits (pour Z inférieur ou égal à 5).
Pourquoi cela ?
Car ainsi ils possèdent le même nombre d’électrons que certains atomes, qu’on appelle les gaz nobles, et qui sont très stables, qui ne réagissent avec rien. Ces gaz nobles sont placés dans la dernière colonne, tout à droite de la classification périodique des éléments chimiques. Ce sont : hélium (He, le plus petit, qui entraîne la règle du duet), néon (Ne), argon (Ar), krypton (Kr), xénon (Xe), radon (Rn).
Les ions et les molécules les plus courants vérifient ces règles.
MOLÉCULE
Espèce chimique constituée par la liaison de plusieurs atomes. Une molécule est électriquement neutre.
Liaison covalente : c’est la liaison entre deux atomes, elle est formée par la mise en commun de deux électrons, chaque électron étant fourni par l’un des atomes de la liaison.
Ce qui est très particulier, c’est que les deux électrons d’une liaison covalente appartiennent à la fois aux deux atomes de la liaison.
Donc : les deux électrons qui forment la liaison covalente appartiennent à la fois aux deux atomes de la liaison.
Exemples :
- La molécule de dihydrogène H2. Chaque atome d’hydrogène possède 1 électron et, selon la règle du duet, il a tendance à en vouloir 2. Les atomes d’hydrogène se prêtent donc leur électron et forment une liaison covalente. Les deux atomes H sont alors entourés de 2 électrons, ils ont le duet et sont stables. La molécule est H – H.
- La molécule de chlorure d’hydrogène, HCl. Pour le chlore, Z=17, (K)2(L)8(M)7. Pour avoir l’octet sur la dernière couche, il faut un électron de plus. Pour H, on a vu qu’il lui faut aussi 1 électron. La molécule est donc H-Cl.
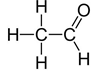
Conséquences : Z(C)=6, donc C possède 4 électrons externes, il en faut 4 en plus pour avoir l’octet : le carbone C doit faire 4 liaisons (on dit que sa valence est 4). Pour l’oxygène O, Z(O)=8, donc 6 électrons externes, il en manque 2 : 2 liaisons covalentes (valence 2).
Remarque : il existe des liaisons covalentes doubles,
où 2 et 2 électrons sont mis en commun, et des liaisons covalentes triples (3
et 3). Et c’est tout. Par exemple, le dioxygène : O=O et le diazote, N ![]() N.
N.
Exercice :
Vérifier que les atomes des molécules suivantes vérifient bien les règles du duet et de l’octet.
|
|
|
|
|
|